近日,美国食品药品监督管理局(FDA)已向Intercept Pharmaceuticals发出了一份完整回复函(CRL),该函件涉及Ocaliva(Obeticholic acid,奥贝胆酸,OCA)的补充新药申请(sNDA),该药物寻求全面批准用于治疗原发性胆汁性胆管炎(PBC)患者。
奥贝胆酸(Obeticholic acid,OCA)是一种法尼酯X受体(FXR)激动剂,此前已在美国FDA加速批准上市,用于治疗原发性胆汁性胆管炎(PBC)。2021年,由于有报告称PBC代偿期或失代偿期肝硬化患者出现肝功能失代偿和衰竭,对此,Ocaliva的处方信息进行了更新,以限制其在特定患者中的使用。具体而言,该治疗适用于没有肝硬化的PBC成年患者或没有门静脉高压证据的代偿性肝硬化患者,可与UDCA疗效不佳的熊去氧胆酸(UDCA)联合使用,或作为不能耐受UDCA的患者的单药治疗。
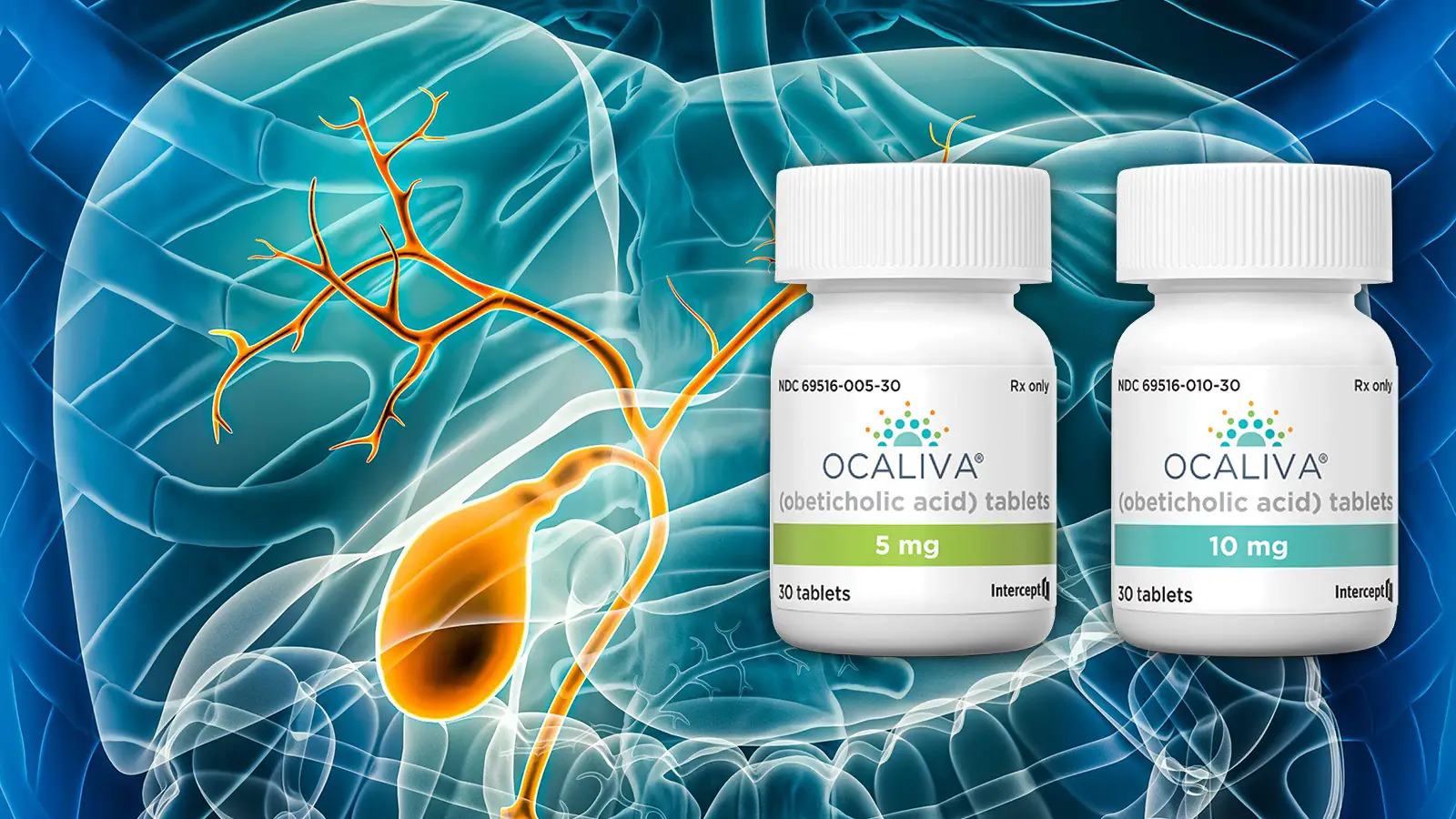
提交了sNDA以支持完全批准OCA用于此适应症,其依据是COBALT试验(ClinicalTrials.gov 标识符:NCT02308111)的数据以及真实世界证据(ClinicalTrials.gov标识符:NCT05292872)。COBALT作为转为传统批准的确认性试验,其结果表明该研究未达到其主要综合终点,该终点定义为首次发生死亡、肝移植、终末期肝病模型评分≥15、不受控制的腹水或导致住院的肝失代偿事件的时间。
COBALT试验的安全性研究结果显示,与安慰剂相比,OCA组的肝移植和死亡人数更多。此外,治疗中还发现药物性肝损伤和瘙痒的风险更高。
由于招募困难,该试验提前终止,但试验中包括一个预先指定的外部对照组(来自Komodo Health US索赔数据库)作为第二个比较组,以评估OCA对首次出现PBC疾病进展的疗效。外部对照分析结果显示,与未接受OCA治疗的外部对照组相比,OCA治疗组的死亡、肝移植和肝功能失代偿率显著降低,且具有临床意义。
据回复函中称,目前美国FDA正在继续评估安全数据,因此无法批准当前形式的补充新药申请(sNDA)。

评论0