全球医疗保健公司Organon于11月5日宣布,美国食品药品监督管理局(FDA)将其审查VTAMA(tapinarof)1%乳膏的补充新药申请(sNDA)的目标行动日期延长三个月,用于治疗成人和两岁及以上儿童的特应性皮炎(AD)。最初的目标行动日期为2024年12月12日,新的目标日期定是2025年3月12日。值得注意的是,该机构没有对最初的申请提出任何安全性、有效性或适应症问题。
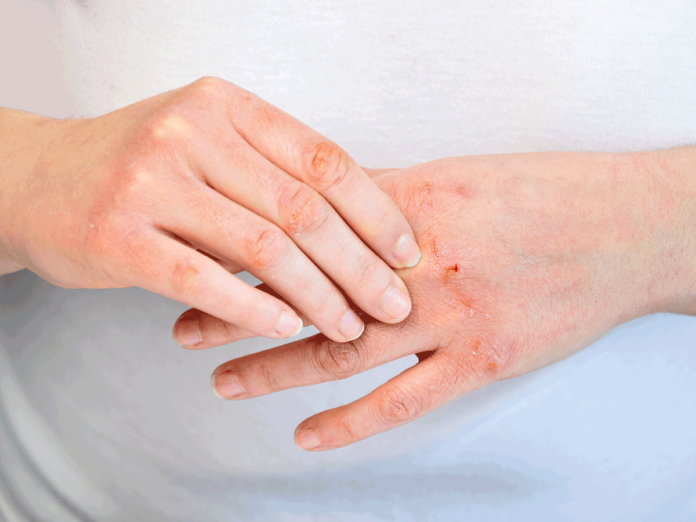
特应性皮炎(AD),通常被称为湿疹,是最常见的炎性皮肤病之一,AD最常发生在儿童中,全世界范围内影响高达20%。这种疾病会导致皮肤瘙痒、红肿和开裂,通常会影响手臂褶皱、膝盖后部、手、脸和脖子。
Tapinarof是一种芳香烃受体激动剂,目前以商品名Vtama获批上市,用于成人斑块型银屑病的局部治疗。
sNDA最初提交的特应性皮炎适应症包括来自3期ADORING 1(ClinicalTrials.gov标识符:NCT05014568)和ADORING 2试验(ClinicalTrials.gov标识符:NCT05032859)的数据,这些试验评估了tapinarof乳膏在成人和儿童AD患者中的疗效和安全性,与载体对照乳膏相比,疗效降低1%。
两项试验的主要终点是获得经过验证的特应性皮炎研究者整体评估(vIGA-AD)评分为清除(0)或几乎清除(1)的参与者比例,并且从基线到8周至少有2级改善。
研究结果显示,在ADORING 1(45.4% vs 13.9%;P <.0001)和ADORING 2(46.4% vs 18.0%;P <.0001)中,使用tapinarof乳膏治疗的患者获得vIGA-AD成功的百分比显著高于使用载体对照乳膏治疗的患者。
在sNDA审查期间,FDA要求提供长期扩展研究ADORING 3(ClinicalTrial.gov 标识符:NCT05142774)的最终数据集和临床研究报告,其中包括疗效终点,例如vIGA-AD评分为清除(0)和vIGA-AD评分为清除(0)或几乎清除(1)。
48周后的结果表明,51.9%接受tapinarof乳膏治疗的患者获得或实现了完全的疾病清除,81.6%获得或实现了清晰或几乎清晰的皮肤。
“Organon仍然对提交给该机构以支持AD Vtama审查的强大疗效和安全性数据包充满信心,我们致力于与FDA合作,确保该机构拥有其审查所需的所有信息,”Organon研发主管Juan Camilo Arjona Ferreira医学博士说。

评论0